Hvordan varierer reaksjonsfarten til en reaksjon med tiden?
Spørsmål - fra Jo:
Reaksjonsfart. Hvordan varierer egentlig reaksjonsfarten til en reaksjon med tiden? Er det en god matematisk formel for dette?
Svar fra Kåre B. Jørgensen
Utgangspunktet for hvor fort en reaksjon går er ganske enkelt. For at vi skal få en kjemisk reaksjon må vi bryte bindinger mellom atomer og lage nye bindinger. For at dette skal skje må molekylene som skal reagere møte hverandre; det vil si støte sammen. Når de møter hverandre må de samtidig ha høy nok energi til å bryte de bindingene som skal brytes. For det tredje må de møtes i riktige vinkler i forhold til hverandre slik at atomene er riktig plassert til å danne de nye bindingene.
Hvor fort skjer så selve reaksjonen? Bindingene i molekyler vibrerer og kan dannes og brytes i løpet av få femtosekunder. Et femtosekund er 10-15 sekunder. Dette er vanvittig raskt, og det er derfor ikke selve reaksjonen som gjør at en kjemisk reaksjon tar tid. Men det vi observerer som reaksjonsfart (reaksjonshastighet) er hvor ofte vi får den rette typen kollisjon mellom molekylene som skal reagere.
Dette kan beskrives matematisk som sannsynligheten for å få en kollisjon som fører til reaksjon. Reaksjonsfarten avhenger da av konsentrasjonene av det som skal reagere (sannsynligheten for kollisjon), temperaturen (sannsynligheten for at molekylene har nok energi), og en konstant (den brøkdelen av antallet kollisjoner som skjer i riktig vinkel mellom molekylene).
Nå er det på tide å gjøre det lettere for oss selv, så la oss holde temperaturen konstant. Da kan vi slå sammen sannsynligheten for riktige vinkler og sannsynligheten til at molekylene har høy nok energi til en felles konstant. Da er reaksjonsfarten enkel matematisk. Vi har en konstant ganger konsentrasjonen av de stoffene som skal delta i reaksjonen. Hvis for eksempel et molekyl av type A skal kollidere med et annet molekyl av type A for å lage et nytt molekyl så vil formelen for reaksjonsfarten (r) bli:
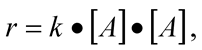
Når reaksjonen går vil konsentrasjonen av A endre seg, slik at med tiden vil reaksjonsfarten bli mindre fordi det er mindre A igjen. Da blir jo sannsynligheten for at A-molekylene skal kollidere mindre. Matematisk kan vi da si at r er endringen i konsentrasjonen av A som funksjon av tiden:
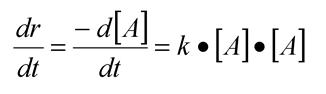
Så er det bare å integrere uttrykket. Da får vi:
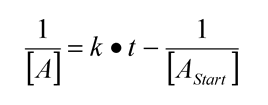
Dette ligner på y=ax+b som er formelen for en rett linje. Hvis vi plotter 1/(konsentrasjonen av A) som en funksjon av reaksjonstiden t så får vi en rett linje hvor stigningstallet er hastighetskonstanten.
Men - - det finnes ikke èn formel for reaksjonsfarten!
Men hvis reaksjonen skjer på en annen måte, så vil vi få en annen formel for reaksjonsfarten. Så det finnes nok ikke èn formel for reaksjonsfarten. Det finnes mange forskjellige formler alt etter hvordan reaksjonen foregår.
Dette utnytter vi til å studere kjemiske reaksjoner. Vi måler hvor fort reaksjonen går, og hvordan farten endrer seg med tiden, og så prøver vi å finne ut hvilken formel som gjelder. Når vi finner riktig formel for reaksjonsfarten så vet vi mye om hvordan reaksjonen foregår. Hvis vi studerer hvordan farten endrer seg med temperaturen, så kan vi finne ut hvor stor energi molekylene må ha for å kunne reagere.
Hvis vi skal lage en fabrikk for å gjøre en kjemisk reaksjon, så må vi vite reaksjonsfarten og formelen for reaksjonsfarten for å kunne regne ut hvordan vi må bygge fabrikken.
Denne læren om hvor fort kjemiske reaksjoner går kaller vi for reaksjonskinetikk. For enkle reaksjoner er det ikke så vanskelig, men for kompliserte reaksjoner kan det bli veldig vanskelig å finne rett ligning for reaksjonen. Derfor er reaksjonskinetikk ofte et eget fag på universitetene, og det er mange forskere som jobber med å studere hvor fort forskjellige reaksjoner går; og hvordan hastigheten endrer seg med tiden, temperaturen, eller andre ting som påvirker reaksjonsfarten.
Kåre B. Jørgensen
Universitetet i Stavanger
(Vist 16441 ganger.)
Emne(r): reaksjonsfart,


